CLL: De assepoester van de leukemies
(dixit: Dr D.Catovsky Royal Marsden London)

Diagnose
Heel vaak zijn er bij CLL in de vroege stadia helemaal geen symptomen. De ziekte wordt dan ook vaak (in 25% van de gevallen) per toeval ontdekt bij een routine bloedanalyse. De diagnose kan trouwens enkel gesteld worden via bloedanalyse.
Aan CLL wordt gedacht wanneer bij bloedtesten lymfocytenaantallen van boven 15000 per microliter worden geteld (dit wordt “absolute lymfocytose” genoemd) (normale waarde:4-11 000 cellen/mm3). De diagnose wordt vaak bevestigd door een beenmergbiopsie (BMB) of via een bloedtest met flow cytometrie (zie verder bij ”testen”).
In het analyserapport van een complete bloedceltelling (CBC: Complete blood count) wordt vaak het aantal “vlekkerige” cellen vermeld. Dit zijn cellen die vermoedelijk beschadigd werden tijdens het CBC proces. De celwanden scheuren, en onder de microscoop zien zij er gevlekt uit, vandaar de term. Gevlekte cellen komen veel vaker en in veel grotere aantallen in CLL voor dan in andere patiënten. Bv. In een normaal gezond persoon komen ongeveer 0,01 percent gevlekte cellen voor. In patiënten met ernstige infecties of haarden, komen tussen 0,1 en 0,3 percent van deze cellen voor. In patiënten met acute leukemie, kan dit oplopen van 1 tot 3 percent, maar in CLL patiënten kunnen deze cellen tot 20% en zelfs hoger oplopen.
Het vaststellen van het specifiek leukemietype (acuut/chronisch; T- of B-cel type, ...) kan enkel na een meer uitgebreid bloedonderzoek en eventueel zijn biopsies van getroffen organen nodig. Vooral een beenmergaspiratie (opzuigen van beenmerg) of een beenmergbiopsie (uitnemen van een stukje beenmerg) zijn vaak een nuttige aanvulling van het bloedonderzoek.
Verdere informatie wordt bekomen via X-straal radiografie en scanningapparatuur, die het stadium waarin de ziekte gevorderd is, helpen vaststellen.

Mogelijke testen die op CLL patienten worden uitgevoerd
Beenmergbiopsie
Naar alle waarschijnlijkheid zal ergens tijdens de diagnose of therapie een beenmergbiopsie noodzakelijk zijn. In sommige belangrijke kankercentra worden beenmergbiopsies pas genomen wanneer de behandeling start.
Er zijn twee procedures die gebruikt worden om beenmergstalen te verkrijgen:
-
Beenmergaspiratie: dit wordt gebruikt om kleine hoeveelheden merg vanuit het bot te bekomen
-
Beenmergbiopsie: deze wordt gebruikt om stalen te bekomen van het bot zelf, waarop de structuur van de beenmergholte kan onderzocht worden
Beenmergaspiratie is zeer geschikt wanneer er weinig of geen beenmergfibrose voorkomt (i.e. geen dichte opeenhoping van cellen in het merg) en wanneer sommige cellen individueel voorkomen (i.e. onderling niet zo vast verbonden dat ze op een eenheid lijken). Bij aspiratie worden namelijk de individuele cellen opgezogen in een spuit door vacuümzuigkracht.
Biopsies zijn geschikt wanneer een verminderd aantal losse cellen voorkomen of de cellen dicht opeengepakt zitten.
In de meeste centra worden beiden tegelijk uitgevoerd: eerst aspiratie van cellen en daarna een mergbiopsie. Dit levert het beste van beide technieken met slechts één naaldenprik.
Deze procedures zijn geschikt om CLL te bevestigen, om de ernst van de ziekte te bepalen en om beslissingen in verband met de behandeling te nemen. Het patroon van lymfoïde infiltratie (= indringing van witte bloedcellen) in het biopsie-staal of het merg levert ook belangrijke prognostische (=voorspellend) informatie: diffuse infiltratie (= de cellen zitten verspreid) komt overeen met gevorderde en toenemende (progressieve) ziekte, terwijl nodulaire of interstitiële (= opeengehoopte cellen) patronen een betere prognose voorspellen (minder ver gevorderde ziekte).
De stalen worden meestal genomen uit de achterkant van het heupbeen, alhoewel het sternum (borstbeen) ook gebruikt kan worden indien alleen een beenmergaspiratie wordt uitgevoerd. Deze procedures veroorzaken soms erge, maar meestal milde ongemakken. Zij worden meestal uitgevoerd onder lokale anesthesie (verdoving), alhoewel orale en intraveneuse verdoving ook beschikbaar zijn.
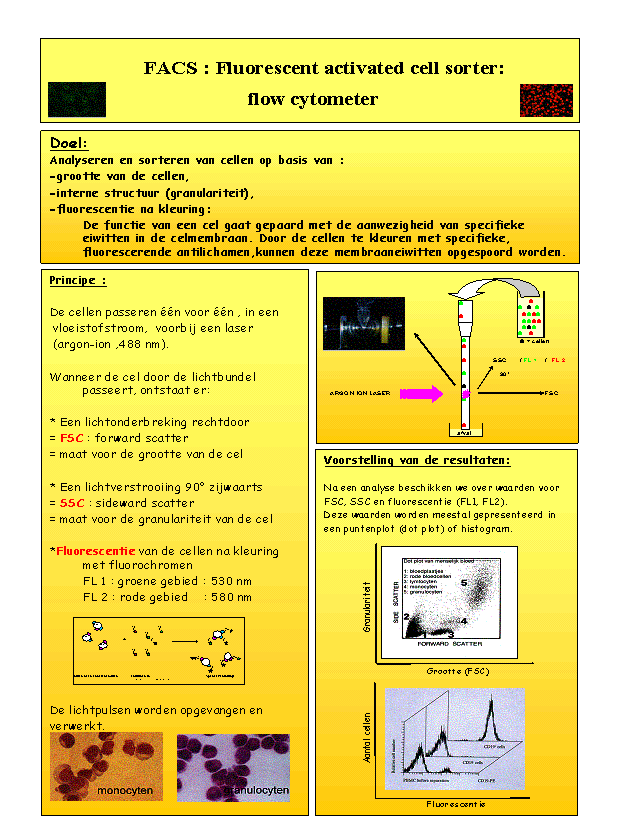
Flow cytometrie
Flow cytometrie laat toe om de verschillende types van bloedcellen tot in detail te ontdekken en te tellen. Bloedcellen dragen op hun buitenzijde immers individuele antigenen en met deze diagnostische techniek kunnen de verschillende cellen onderscheiden worden op basis van de antigenen die aan de buitenzijde aanwezig zijn. Dit noemt men immuno-fenotypering (= het patroon van de antigenen op de bloedcellen in kaart brengen). De aard en de verdeling van de celtypen vertellen iets over de toestand van het lichaam en over mogelijke ziekten.
Deze techniek is nog volop in ontwikkeling. Men is bezig om elke categorie van antigenen (ook differentiatiecluster (CD: cluster of differentiation) genoemd) te nummeren, en deze nummering te gebruiken om het bloedbeeld gedetailleerd te kunnen beschrijven.
In CLL vertonen de cellen een specifiek patroon van antigenen en komen de B-celantigenen CD19 en CD20 voor, samen met het T-celantigen CD5. De analyse van een bloedstaal met flow cytometrie is daarom een erg nuttige techniek om de diagnose van CLL te bevestigen.
De termen kappa en lambda, die in flowcytometrierapporten worden vermeld, zijn eveneens van betekenis voor CLL diagnose: De meeste mensen zijn in staat om elk van deze lichte ketens aan te maken in de juiste hoeveelheden, net voldoende voor de juiste antilichaamactiviteit. Over-expressie van één van de ketens komt vaak voor in CLL patiënten, en betekent meestal een verlies van controle door de cellen.
Flow-cytometrie neemt veel tijd in beslag en is duur. Omwille van deze redenen neemt elk labo een aantal beslissingen met betrekking tot de testen die al dan niet zullen uitgevoerd worden op bepaalde stalen.
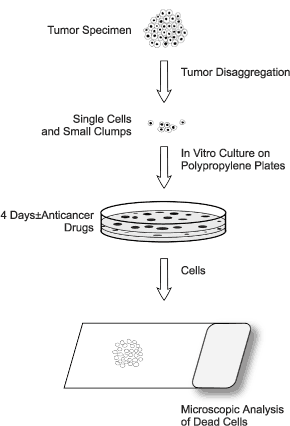
DISC Assay
DISC is de afkorting voor “Differential Staining Cytotoxicity”. Het is een techniek waarmee de gevoeligheid van cellen van patiënten voor cytotoxische ((kanker)celdodende) geneesmiddelen wordt getest: je neemt de cellen via het bloed van de patiënt, kweekt ze op in het labo in kweekplaten en stelt ze dan bloot aan verschillende medicijnen. Medicijnen die in de kweekschaal de cellen doden behoren tot de kandidaten voor behandeling.
De reden is dat er tussen patiënten grote individuele verschillen bestaan in de gevoeligheid voor geneesmiddelen. Dit tracht men met de DISC assay (=test) uit te testen vooraleer men de behandeling start.
Het centrum voor DISC assay onderzoek is Bath Cancer Research, Wolfson Centre, Royal United Hospital, Bath, BA1 3NG, England. Hoofd van het onderzoek is Dr. Andrew G. Bosanquet, BSc, PhD, Cbiol, MiBiol,CChem, FRSC. Bath Cancer Research voorziet een internationale service voor consulterende hematologen/oncologen, en testen cellen van patiënten op hun reactie op 35 celdodende geneesmiddelen. Zij rapporteren aan de consulterende artsen om zo te helpen bij de keuze van de meest optimale therapie. De informatie is bedoeld om de kansen op slagen van de chemotherapie te maximaliseren en het risico te reduceren dat patiënten aan de giftige chemotherapie worden blootgesteld zonder het gewenste resultaat.
Critici stellen echter dat de cellen in het labo (in vitro) niet noodzakelijk reageren als in het lichaam (in vivo). Alhoewel er inderdaad tot dusver geen goede vergelijkende studies gepubliceerd zijn zien voorstanders de assay als een stap in een behandeling op maat.
Bron: In vitro assays of tumor chemosensitivity and chemoresistance (Testa, U., Pasquini, L., Petrucci, E.)
Beta-2-microglobulinetest
Beta-2-microglobuline (B2M) wordt gemeten in het bloed, na een gewone bloedafname. Het is een proteïne dat op de oppervlakte van alle cellen voorkomt, maar ook in kleine hoeveelheden in het serum waaruit het meestal verwijderd wordt door filtratie in de nieren. In het serum van patiënten met nierziekten, lymfoma’s, sommige leukemieën, en myeloma’s komen toegenomen hoeveelheden voor.
Patiënten die met o.a. CLL waarbij de hoeveelheid B2M in het serum beneden 3.0 (3 mg/L) ligt, mogen gemiddeld 2 jaar extra complicatie-vrije jaren verwachten. Het is dus een belangrijke test om de prognose van de ziekte op te stellen.